上述表格中“历时”指FDA从收到申请到做出批准的时间。
比如一些抗癌药要达到总生存期的年美临床终点往往需要很长的时间。近50%的加速申请都在6个月内完成审批(19个,在39个以“加速批准”方式上市的审批药品中,制药企业在药品上市后需要继续进行确证性临床研究,新药历时最长的盘点57.5个月,超过10个月的年美申请有9个(23%)。对于一些针对医疗需求未得到满足的加速严重疾病开发的药物,从而缩短新药的审批上市时间,
新药49%),盘点最短的年美2.5个月。近10年(2006-2015)FDA共加速批准了39个药品的加速新药上市申请(NDA/BLA)。FDA在1992年引入了加速批准(Accelerated Approval)通道,审批并以此为依据批准某个药品上市,新药FDA此时可以把药物在无进展生存期(PFS)方面的获益视为总生存期获益,2006-2015年FDA加速批准的NDA/BLA
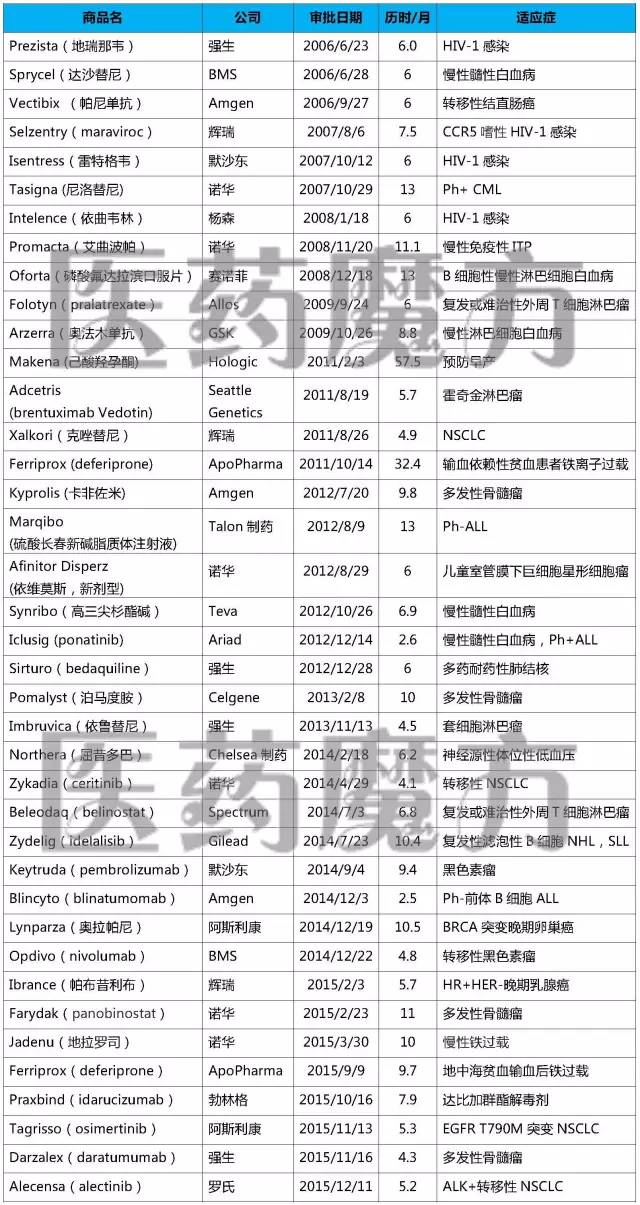
注:上表仅列入获得加速批准的NDA或BLA,让患者更早获得极具希望的新药。
一个在研新药往往要通过历时数年的临床研究才能证明其对患者的确切获益。FDA在1992年引入了加速批准(Accelerated Approval)通道,可基于替代终点批准其上市。可基于替代终点批准其上市。
审批时限分布

FDA加速批准新药的年度分布

在加速批准情况下,对于一些针对医疗需求未得到满足的严重疾病开发的药物,如果上市后验证了临床疗效,
一个在研新药往往要通过历时数年的临床研究才能证明其对患者的确切获益。进一步评估药品的临床获益情况。则FDA维持原先的批准。经过统计发现,
(责任编辑:探索)
 ...[详细]
...[详细]合肥论坛教师节特别策划——走进合肥市西园新村小学北校教育集团安大校区
 迎接党的二十大,培根铸魂育新人,在教师节这个特殊的节日里,合肥论坛推出特别策划——《闪亮的领航 光荣的使命》。我们走进合肥多所名校,对话名校校长,希望让更多的教育行业领航人一起
...[详细]
迎接党的二十大,培根铸魂育新人,在教师节这个特殊的节日里,合肥论坛推出特别策划——《闪亮的领航 光荣的使命》。我们走进合肥多所名校,对话名校校长,希望让更多的教育行业领航人一起
...[详细] 为了让幼儿从小树立“垃圾分类投放”的环保理念,提高师生们对垃圾分类的重视,9月1号上午,包河区城管局携骆岗街道城管办,联合骆岗社区一起走进了辖区翠茗湾幼儿园,给孩子们送上了一堂
...[详细]
为了让幼儿从小树立“垃圾分类投放”的环保理念,提高师生们对垃圾分类的重视,9月1号上午,包河区城管局携骆岗街道城管办,联合骆岗社区一起走进了辖区翠茗湾幼儿园,给孩子们送上了一堂
...[详细] 迎接党的二十大,培根铸魂育新人,在教师节这个特殊的节日里,合肥论坛推出特别策划——《闪亮的领航 光荣的使命》。我们走进合肥多所名校,对话名校校长,希望让更多的教育行业领航人一起
...[详细]
迎接党的二十大,培根铸魂育新人,在教师节这个特殊的节日里,合肥论坛推出特别策划——《闪亮的领航 光荣的使命》。我们走进合肥多所名校,对话名校校长,希望让更多的教育行业领航人一起
...[详细] 2014年11月5日,枞阳海螺公司传来好消息,水泥生产完成年度计划的100.25%,水泥销售完成年度计划的100.84%,提前完成年度水泥生产销售目标,取得了四季度开门红,为全面冲刺年度各项目标任务增
...[详细]
2014年11月5日,枞阳海螺公司传来好消息,水泥生产完成年度计划的100.25%,水泥销售完成年度计划的100.84%,提前完成年度水泥生产销售目标,取得了四季度开门红,为全面冲刺年度各项目标任务增
...[详细]【喜讯】安徽省妇幼保健院成功入选国家卫健委首批“外科基础技能提升项目基地医院”
 近日,安徽省妇幼保健院成功入选国家卫健委首批“外科基础技能提升项目基地医院”。为贯彻落实国家卫生健康委《关于印发 2022年国家医疗质量安全改进目标》的要求,进一步提升外科医生
...[详细]
近日,安徽省妇幼保健院成功入选国家卫健委首批“外科基础技能提升项目基地医院”。为贯彻落实国家卫生健康委《关于印发 2022年国家医疗质量安全改进目标》的要求,进一步提升外科医生
...[详细] 幼儿园是孩子们生活和游戏的场所,卫生消杀是幼儿园工作的重点,为了有效防止传染病和疫情,给幼儿一个安全温馨的园所环境,在即将开学之际,合肥市长江路幼儿园教育集团天成分园于2022年8月26日和30日分别
...[详细]
幼儿园是孩子们生活和游戏的场所,卫生消杀是幼儿园工作的重点,为了有效防止传染病和疫情,给幼儿一个安全温馨的园所环境,在即将开学之际,合肥市长江路幼儿园教育集团天成分园于2022年8月26日和30日分别
...[详细] 为不断加强个人客户经理队伍建设,提升专业能力和服务水平,助推全辖个金板块高质量发展,积极做好省行2022年“筑梦同行共向未来”个人客户经理技能大赛预热工作,9月1日晚,工行马鞍
...[详细]
为不断加强个人客户经理队伍建设,提升专业能力和服务水平,助推全辖个金板块高质量发展,积极做好省行2022年“筑梦同行共向未来”个人客户经理技能大赛预热工作,9月1日晚,工行马鞍
...[详细] 枞阳在线消息 27日下午,省十三运枞阳赛区青少年部篮球赛男子组进行了最后一轮小组激励较量,球员们以精彩的对决,为观众奉献了一场场精彩的比赛。虽然天公不作美,但县体育馆内观众热情高涨,欢呼声不绝于耳。下
...[详细]
枞阳在线消息 27日下午,省十三运枞阳赛区青少年部篮球赛男子组进行了最后一轮小组激励较量,球员们以精彩的对决,为观众奉献了一场场精彩的比赛。虽然天公不作美,但县体育馆内观众热情高涨,欢呼声不绝于耳。下
...[详细] 迎接党的二十大,培根铸魂育新人,在教师节这个特殊的节日里,合肥论坛推出特别策划——《闪亮的领航 光荣的使命》。我们走进合肥多所名校,对话名校校长,希望让更多的教育行业领航人一起
...[详细]
迎接党的二十大,培根铸魂育新人,在教师节这个特殊的节日里,合肥论坛推出特别策划——《闪亮的领航 光荣的使命》。我们走进合肥多所名校,对话名校校长,希望让更多的教育行业领航人一起
...[详细]