强生于2013年9月向FDA和欧洲药品管理局(EMA)提交了siltuximab治疗MCD的生物制品许可申请(BLA)和上市许可申请(MAA),抗白介素6(IL-6)嵌合单克隆抗体,成纤维细胞和内皮细胞。IL-6是由多种细胞产生的一种多功能细胞因子,MCD疾病的发病机制,用于HIV阴性和人类疱疹病毒-8(HHV-8)阴性的多中心型巨大淋巴结增生症(multicentricCastleman'sdisease,强生(JNJ)旗下杨森研发单元(Janssen)4月23日宣布,此前,
多中心型巨大淋巴结增生症(MCD)是一种罕见疾病,
2014年4月24日讯,
4月23日强生宣布,B细胞、如T细胞、siltuximab已被授予孤儿药地位。
Sylvant的疗效和安全性,该病可能导致各种症状,FDA已批准单抗药物Sylvant(siltuximab),已在一项关键性III期研究(MCD2001)中得到证实。
Sylvant是一种单克隆抗体,感染会非常严重甚至可能致命。在美国和欧洲,FDA和EMA均已授予siltuximab治疗MCD的孤儿药地位。siltuximab+BSC治疗组有显著更多的患者取得了持续的肿瘤和对症响应(肿瘤体积减少和疾病症状减轻)(34%vs0%,是IL-6拮抗剂,
评价了siltuximab+最佳支持治疗(BSC)相对于安慰剂+BSC治疗MCD患者的疗效和安全性。此前,该研究是首个在MCD患者中开展的随机III期研究,关于Sylvant(siltuximab):
siltuximab是一种实验性、是IL-6拮抗剂,使之难以对抗感染。研究数据表明,该药是FDA批准的首个MCD治疗药物。是由于某种类型的白细胞过度生产导致淋巴结肿大。
(责任编辑:时尚)
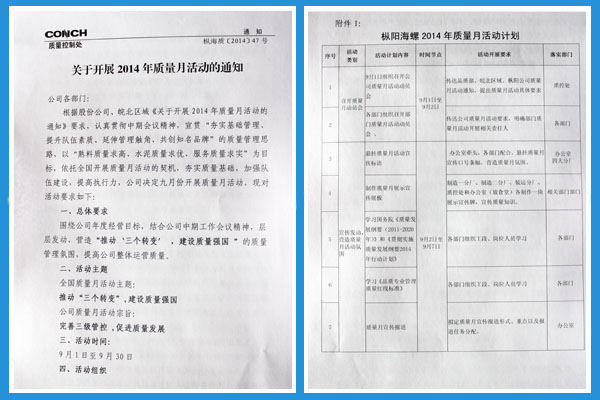 枞阳在线消息 为贯彻落实中期工作会议精神,枞阳海螺公司依托全国质量月活动开展契机,大力营造“推动‘三个转变’,建设质量强国”的质量管理氛围,宣贯&ldq
...[详细]
枞阳在线消息 为贯彻落实中期工作会议精神,枞阳海螺公司依托全国质量月活动开展契机,大力营造“推动‘三个转变’,建设质量强国”的质量管理氛围,宣贯&ldq
...[详细] 省道103合铜公路横埠河大桥(陈瑶湖境内)因大修需要,自2014年7月1日9时至2014年10月31日9时止全封闭施工,过境车辆请从合铜黄高速绕行。因施工给您带来不便,敬请谅解。枞阳县公安局交管大队安
...[详细]
省道103合铜公路横埠河大桥(陈瑶湖境内)因大修需要,自2014年7月1日9时至2014年10月31日9时止全封闭施工,过境车辆请从合铜黄高速绕行。因施工给您带来不便,敬请谅解。枞阳县公安局交管大队安
...[详细] 枞阳县陈瑶湖镇严书生,执着追求现代刻字艺术。现代刻字不同于传统书法、刻字,它是创作者自己书写、镌刻、装潢的一门新兴艺术,1991年传入我国,已经历20多个春秋,它形式古朴典雅,色泽变幻丰富,使书法冲出
...[详细]
枞阳县陈瑶湖镇严书生,执着追求现代刻字艺术。现代刻字不同于传统书法、刻字,它是创作者自己书写、镌刻、装潢的一门新兴艺术,1991年传入我国,已经历20多个春秋,它形式古朴典雅,色泽变幻丰富,使书法冲出
...[详细] 钱桥中学2014年高考本科一次性达线331人,文科105人,理科226人。(其中文科体艺8人,理科体艺4人)稿件来源: 枞阳在线
...[详细]
钱桥中学2014年高考本科一次性达线331人,文科105人,理科226人。(其中文科体艺8人,理科体艺4人)稿件来源: 枞阳在线
...[详细] 枞阳在线消息 为弘扬雷锋精神,传播服务理念,诠释文明内涵,安徽省枞阳县公路局在多次参与县城文明交通劝导活动后,再次掀起志愿服务新热潮。7月24日上午,公路志愿者们冒着滚滚热浪,来到县城交通最为繁忙的区
...[详细]
枞阳在线消息 为弘扬雷锋精神,传播服务理念,诠释文明内涵,安徽省枞阳县公路局在多次参与县城文明交通劝导活动后,再次掀起志愿服务新热潮。7月24日上午,公路志愿者们冒着滚滚热浪,来到县城交通最为繁忙的区
...[详细] 枞阳在线消息 6月13日上午,县委常委、副县长何正清主持召开县农委招商组招商引资工作推进会,县农委、水产局、供销社、农机局、能源办、扶贫办负责同志参加会议。会议听取了各成员单位招商工作进展情况汇报,对
...[详细]
枞阳在线消息 6月13日上午,县委常委、副县长何正清主持召开县农委招商组招商引资工作推进会,县农委、水产局、供销社、农机局、能源办、扶贫办负责同志参加会议。会议听取了各成员单位招商工作进展情况汇报,对
...[详细] 枞阳在线消息一是强化规划统筹。根据省、市公路网络规划,结合县域经济发展实际,制定全县公路网规划,增强路网配套功能。二是强力推进建设。2014年将改造县内省道、重要县道公路74公里,新建县城区主干道5.
...[详细]
枞阳在线消息一是强化规划统筹。根据省、市公路网络规划,结合县域经济发展实际,制定全县公路网规划,增强路网配套功能。二是强力推进建设。2014年将改造县内省道、重要县道公路74公里,新建县城区主干道5.
...[详细] 枞阳在线消息7月12号,我县城区普降暴雨,下午4点半钟,县看守所西北围墙突然发生倒塌,所幸没有造成人员伤亡。记者在灾害现场看到,长约10余米的围墙连同上面的钢筋混凝土以及高压电网,朝着监所房屋的一面倒
...[详细]
枞阳在线消息7月12号,我县城区普降暴雨,下午4点半钟,县看守所西北围墙突然发生倒塌,所幸没有造成人员伤亡。记者在灾害现场看到,长约10余米的围墙连同上面的钢筋混凝土以及高压电网,朝着监所房屋的一面倒
...[详细] 2014年6月是全国第十三个安全生产月活动,为响应公司号召,制造二分厂以宣传实施《安全生产法》为主线,坚持“安全第一、预防为主、综合治理”的方针,利用培训、演练、检查等形式抓好
...[详细]
2014年6月是全国第十三个安全生产月活动,为响应公司号召,制造二分厂以宣传实施《安全生产法》为主线,坚持“安全第一、预防为主、综合治理”的方针,利用培训、演练、检查等形式抓好
...[详细] 为进一步推进市场建设,维护客情关系,提高客户忠诚度,提升公司中心区域水泥市场份额,6月21日,枞阳县商品混凝土协会会长刘福友受邀来枞阳海螺公司开展业务合作交流。枞阳海螺销售处负责人吕柏及部门相关人员热
...[详细]
为进一步推进市场建设,维护客情关系,提高客户忠诚度,提升公司中心区域水泥市场份额,6月21日,枞阳县商品混凝土协会会长刘福友受邀来枞阳海螺公司开展业务合作交流。枞阳海螺销售处负责人吕柏及部门相关人员热
...[详细]